Parce que l’évolution.
Au-delà de l’aspect humoristique d’une réponse aussi laconique, c’est une chose à garder en mémoire lorsque l’on souhaite aborder les sciences de la vie et de la santé, même en ce qui concerne les problématiques actuelles les plus quotidiennes et abordées dans les grands médias : santé, alimentation, agronomie… L’évolution par sélection naturelle n’est pas un lointain concept réservé aux dinosaures ou autres vieilleries. Ainsi donc, même dans un sujet relatif à votre santé comme celui de la grippe saisonnière, il y a de vrais gros morceaux d’évolution, comme nous allons le voir dans ce billet dont l’essentiel de la documentation est issue du chapitre 11 du livre Les maladies infectieuses, par Benjamin Roche.
Ensuite il est bon de rappeler quelques faits techniques. Non seulement parce que c’est intéressant en soi, mais aussi parce que trop de blogs / pages internet / groupes Facebook ou médias mainstreams complètement farfelus pullulent sur les thèmes de la santé et des sciences de la vie en général. Bien souvent, ces médias déterrent des concepts pré ou pseudo-scientifiques pour défendre des visions de la santé personnelle et publique assez éloignées des réalités de ce monde. Non seulement les bases factuelles sont ignorées, par exemple sur la vaccination en ce qui concerne des concepts clef comme la mortalité, la morbidité, l’incidence, la prévalence, etc., mais également les bases scientifiques qui permettent d’appréhender ces faits, comme la théorie des germes ou la théorie de l’évolution. Souvent la méconnaissance (normale, on ne peut pas tout connaître sur tout) est entretenue chez certaines personnes par d’autres, actrices de la désinformation et de la défiance vis-à-vis de ce qui est vu comme la science ou la médecine « officielles ». Ces discours là sont extrêmement pernicieux, car il est très difficile de faire entendre raison à quelqu’un de parfaitement ignorant de la microbiologie ou de l’évolution et qui a par ailleurs préalablement décidé que ces champs disciplinaires étaient une sorte de doxa « officielle » qu’il fallait à tout prix rejeter et combattre, et qu’elles ne s’y intéresseraient donc jamais de manière factuelle et rationnelle. Ce n’est pas à ces personnes là que je souhaite m’adresser ici, mais plutôt aux personnes qui sont véritablement en questionnement, ou bien parce que le sujet les intéresse pour leur culture et leur curiosité scientifique, ou bien parce qu’elles sont tombées sur l’un de ces nombreux médias qui entretiennent la désinformation, notamment le très dangereux mouvement anti-vacciniste.
Alors, si ce n’est pas pour engraisser l’industrie pharmaceutique ou satisfaire une conspiration reptilienne eugéniste, pour quelle raison fondamentale est-il recommandé de se faire vacciner tous les ans contre la grippe saisonnière ?
La grippe saisonnière est causée par le virus Influenza. Pour vous qui lisez ces lignes, cette maladie est probablement de première importance puisque c’est encore l’une des principales causes de mortalité infectieuse dans les pays développés :

Figure 1 Cohen 2000, Changing patterns of infectious disease, Nature. Les 10 principales causes de mortalité aux USA de 1900 à 1997
On observe en effet sur le graphique ci-dessus le changement de pattern, c’est à dire de schéma dans les principales causes de mortalité aux USA du début à la fin du 20ème siècle. On constate assez aisément que le fardeau infectieux a été battu en brèche, laissant la place au problème suivant des maladies chroniques. Une cause infectieuse demeure présente et importante cependant en 1997 : Influenza, la grippe.
Avec environ 3 à 5 millions de cas chaque année et 500 000 décès touchant essentiellement des personnes de plus de 65 ans, cette observation est tout sauf anodine.
La force de l’Influenza, c’est sa capacité de mutation faramineuse, et cette vitesse de mutation importante est à l’origine d’une forte diversité des différentes souches du virus. Cette diversité générée chez le virus de la grippe est tellement importante qu’on doit le classer en sous-types en fonction de mutations caractéristiques communes aux souches de ces groupes. Ces mutations ont pour conséquence importante la modification de certaines molécules présentes à la surface du virus, l’hémagglutinine (H) et la neuraminidase (N). Ces molécules sont importantes, car c’est grâce à elles que le virus va arriver respectivement à entrer et sortir de la cellule infectée. C’est en somme un système de clefs et de serrures, et ces molécules représentent le set de clefs dont dispose un virus pour tenter de rentrer dans une cellule. Les différentes souches virales, au gré de leurs mutations sur des gènes codant l’expression (la « fabrication ») de ces clefs, peuvent générer plusieurs combinaisons, plusieurs sets de clefs possibles : H3N2, H5N9, H1N1…
En clair, des mutations sur le génome du virus entrainent des modifications phénotypiques sur le virus, c’est-à-dire des modifications de l’expression des gènes modifiés. C’est là que nos considérations de départ entrent en jeu, car ces modifications génotype/phénotype ne sont rien d’autre que la base même du processus de l’évolution naturelle. Or, cette évolution générée par des mutations aléatoires sur le génome des individus porte ici sur l’expression du variant antigénique du virus, ces fameuses clefs qui vont lui permettre éventuellement de cracker les cellules infectées. C’est là qu’entrera en scène un autre principe, celui de la sélection naturelle. J’y reviendrai.
Cette dynamique évolutive du virus de la grippe est caractérisée par un phénomène qu’on appelle le shift. Ce shift consiste en l’éloignement suffisant du variant antigénique (les clefs, cf. supra) d’une nouvelle souche grippale par rapport aux souches circulantes à ce moment là dans l’environnement, pour que la population infectée soit à ce moment précis naïve immunologiquement face à ce variant. La naïveté immunologique est l’état définissant un système immunitaire n’ayant jamais été confronté, n’étant pas préparé et n’étant conséquemment pas prédisposé à se défendre contre un pathogène qu’il n’a encore jamais rencontré. Généralement, ces shifts sont dus au passage d’un virus de l’animal non-humain à l’humain. Le virus de la grippe est effectivement commun à plusieurs animaux dont les humains et les oiseaux, et c’est souvent depuis ces derniers qu’évoluent de nouvelles souches dangereuses pour l’espèce humaine qui n’y est pas habituée, d’où l’expression « grippe aviaire », « qui vient des oiseaux ».
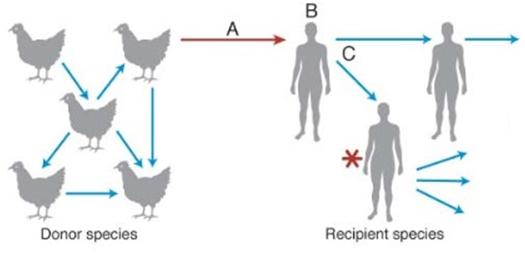
2 Kuiken et al., 2006, Schéma de phase de transmission d’une souche grippale aviaire à l’humain. A. contact interspécifique (par exemple dans un élevage de volailles) B. Infection du nouvel hôte par le virus et réplication suffisante C. Contact interhumain permettant la dispersion du virus (une partie du schéma a été retirée pour la simplicité du propos de ce billet).
Ces shifts peuvent provoquer des dispersions mondiales d’une nouvelle souche virale qu’on appelle alors une pandémie. C’est exactement ce qui s’est passé à la fin de la première guerre mondiale lorsque la grippe espagnole a décimé 20 à 40 millions d’européens. Le virus de la grippe est l’objet de nombreuses mutations qui accroissent sont potentiel pandémique, mais il est également l’objet de réassortiments. Le réassortiment est le phénomène au cours duquel deux souches virales circulantes dans le même environnement échangent une partie de leur matériel génétique de telle façon qu’une nouvelle souche en résulte. Dès lors, le même problème de variance antigénique, c’est-à-dire de ré-assemblage de sets de clefs possibles, a lieu, ce qui amplifie d’autant plus le risque encouru par un système immunitaire naïf face à cette nouvelle souche réassortie. Sur la base d’une mutation à l’origine du saut d’espèce entre l’oiseau et l’homme ayant abouti à la grippe espagnole de 1918, des réassortiments ultérieurs ont donné lieu à de nouvelles pandémies. On peut ainsi évoquer la grippe asiatique de 1957, ou encore la grippe de Hong Kong en 1968-69 à l’origine de 2 millions de morts dont plus de 30 000 en France métropolitaine.
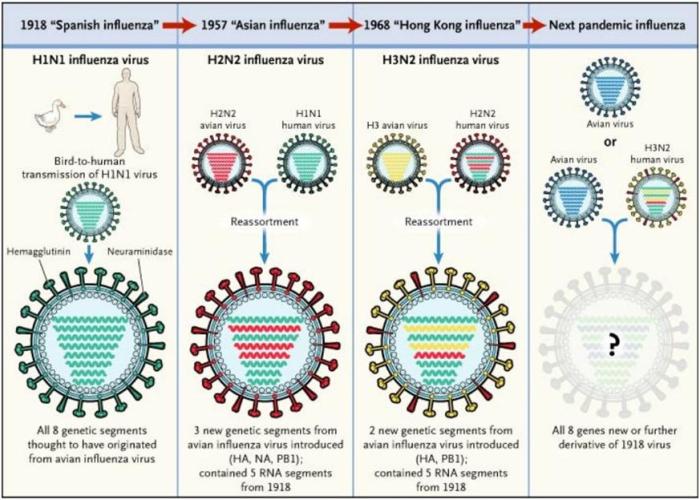
3 Belshe, 2005, Les deux mécanismes par lesquels les pandémies grippales apparaissent. En 1918 une souche aviaire H1N1 s’est adaptée à la réplication chez un hôte humain. En 1957 et en 1968, des réassortiments ont conduit à de nouveaux virus à l’origine de pandémies. Le virus Influenza de 1957 a acquis 3 segments génétiques d’une souche aviaire, et le virus de 1968 en a acquis 2. Ce schéma prédisait en 2005 que la prochaine pandémie devrait suivre le même processus. C’est effectivement ce qu’il s’est passé en 2009.
A ces shifts et réassortiments s’ajoutent les drifts, c’est-à-dire « la dérive ». A chaque nouvelle saison de grippe, donc chaque année, de nouvelles mutations apparaissent aléatoirement dans le génome des souches circulantes dans les populations humaines. Lors d’une épidémie, une mutation devient dominante au sein de ces populations, et de fait, son variant antigénique (son set de clefs) devient également dominant. D’autres mutations qui aboutissent à des sets de clefs proches peuvent circuler en même temps, lors de la même épidémie, mais cette proximité rend la protection du système immunitaire contre la souche dominante partiellement efficace contre ces souches proches. Lorsque l’épidémie se termine, la place laissée vacante par la souche dominante peut être prise par une autre souche, légèrement différente, et donnant lieu à une nouvelle épidémie. C’est ce qu’on appelle l’échappement immunitaire.

4 McHardy et Adams, 2009, La génération de diversité génétique et antigénique (clefs) au cours de l’évolution du virus humain de l’Influenza A. Explications dans le paragraphe infra.
Vous connaissez maintenant les principes de la mutation, du réassortiment, de la dérive, et de l’échappement immunitaire appliqués au virus de la grippe. Ce doit être l’instant où tout s’illumine, car tout ça caractérise l’évolution permanente de ce virus, et la connaissance que nous avons par ailleurs des mécanismes de l’évolution peuvent nous permettre d’envisager des stratégies thérapeutiques pour nous prémunir contre ce virus. L’ensemble de ces mécanismes se trouve représenté graphiquement dans la figure 4 ci-dessus : les différents ronds bordés de piques représentent des souches virales circulant dans une population humaine et dont on peut voir 2 groupes de souches apparentées à l’origine, les bleues et les jaunes ; la colonne de souches bleues et jaunes à gauche représente la diversité génétique (des souches) présente dans la population au début du processus ; les flèches blanches indiquent un lien de parenté entre une souche mère et une souche fille ; les marques blanches sur les génomes contenus à l’intérieur des ronds représentent des mutations neutres sans effet ; les marques roses sur le génome à l’intérieur des ronds représentent des mutations ayant un effet sur l’expression antigénique de la souche (son set de clefs) ; les piques à la surface des ronds représentent différents variants antigéniques (les sets de clefs) ; les flèches oranges indiquent la provenance des segments de génomes depuis une souche mère à une nouvelle souche fille ayant subi un réassortiment.
Au gré de la circulation des souches virales dans la population humaine, l’immunité contre ces souches dans la population grandit et devient de plus en plus efficace, ce qui conduit à un goulot d’étranglement représenté par la constriction de la zone bleue sur le graphique. En parallèle, des mutations qui affectent la variation antigénique (les sets de clefs représentés par les piques) s’accumulent dans la population virale jusqu’à ce qu’aléatoirement, l’une de ces mutations soit suffisamment différente pour contourner l’immunité grandissante de la population humaine : la souche virale échappe à la défense immunitaire humaine construite au cours du processus précédant, c’est l’échappement immunitaire.
Cette dynamique évolutive du virus de la grippe qui aboutit à cet échappement immunitaire est particulièrement casse-burnes.
Car en effet, le vaccin contre la grippe a pour objectif de cibler l’hémagglutinine (H), la clef qui permet au virus d’entrer dans la cellule. Or, le vaccin ne peut logiquement être d’une efficacité optimale que le temps où la bonne clef H sera dominante dans la population virale et contre laquelle le vaccin aura été développé. Dès lors qu’une mutation entrainera l’apparition d’une clef H suffisamment différente (H5 au lieu de H1 par exemple), le virus pourra échapper à la défense immunitaire.
Que faire alors ? Certainement pas « rien » comme le proposeraient des antivaccinistes en alléguant que puisque le virus évolue, la lutte est vaine voire plus dangereuse encore. Car outre le fait que cela repose sur une vision hautement eugéniste et scandaleuse de la santé publique, et que toutes les données convergent vers la démonstration de l’efficacité de la vaccination, ça revient clairement au même que de dire « pourquoi se laver aujourd’hui puisqu’on va se resalir demain ».
Toute la stratégie vaccinale va donc consister à mettre à jour les souches utilisées dans le vaccin selon les souches susceptibles de circuler l’année suivante dans les populations humaines. Cette stratégie n’est rendue possible que grâce à la compréhension approfondie des mécanismes évolutifs expliqués précédemment. Grâce à cela en effet, l’OMS a mis en place un système de prédiction des souches en circulation l’année suivante, prédictions publiées deux fois par an et qui fondent les recommandations officielles adressées aux industries pharmaceutiques de sorte à ce que celles-ci mettent à jour le vaccin de l’année précédente.
Plus de 120 centres internationaux répartis dans 96 pays et coordonnés par 5 centres collaborateurs de l’OMS ont pour mission de récupérer les souches circulantes de l’année en cours de manière la plus exhaustive possible. L’hypothèse est alors formulée que les souches en circulation dans l’hémisphère sud pendant la saison de la grippe donneront les souches en circulation dans l’hémisphère nord à la saison suivante (respectivement mai-août et novembre-mars) par migration. Afin de déterminer quelles souches vont êtres utilisées dans la dose vaccinale, des expérimentations en laboratoire sont faites afin de mesurer à la fois le potentiel de mutation des souches de l’année précédente et si celui-ci est toujours couvert par le vaccin, et le potentiel des souches en circulation récoltées durant l’année par les centres internationaux. Si la protection conférée par le vaccin de l’année précédente n’est pas suffisante, alors un nouveau vaccin est créé en fonction des différentes caractéristiques des nouvelles souches circulantes : leur proximité phylogénétique avec les souches précédentes, leur distribution géographique, leur prévalence dans différentes populations, leur virulence, leur pathogénicité, etc..

5 Russell et al., 2008, Schéma des routes principales de migration de la souche grippale A(H3N2).
Cette stratégie de lutte vaccinale a été développée en 1971 et a depuis largement fait ses preuves en permettant une immunité croisée a posteriori de 60% contre des souches éloignées de la souche vaccinale et de 83% pour des souches proches, ainsi que par une diminution considérable de la mortalité. La grosse limite de cette méthode reste sa difficulté de mise en œuvre. C’est en effet un processus extrêmement long et complexe qui demande en outre d’attendre le plus longtemps possible pour éviter qu’une nouvelle souche dominante se présente après que la production du vaccin soit lancée. De fait, contrairement à ce qui est généralement préconisé, l’objectif de la vaccination anti grippale n’est pas tant l’éradication par une couverture vaccinale maximum comme c’est généralement le cas en première intention pour les autres vaccins, mais la préservation ciblée des populations à risque, comme les plus de 65 ans.
Une telle stratégie n’est permise que par la compréhension des mécanismes biologiques dépendant des processus évolutifs à l’œuvre. Évidemment, d’autres stratégies sont toujours en développement, notamment la possibilité de cibler d’autres sites du virus, moins variables et donc plus faciles à doubler sur le plan de cette course à l’armement évolutive. D’autres tentatives visent quant à elles l’amélioration des nos modèles mathématiques avec la capacité de prédire non pas une, mais deux saisons en avance l’évolution du virus.
Si l’on considère notre arsenal thérapeutique préventif comme faisant partie de notre phénotype étendu, une expansion de notre propre système immunitaire, cette course à l’armement perpétuelle engagée contre les agents infectieux comme le virus de la grippe entrent pleinement dans le modèle co-évolutif de Van Vallen. Dans ce modèle, la sélection naturelle que j’évoquais plus haut promeut les souches aptes à pratiquer l’échappement immunitaire et à résister à nos contre-mesures. Souvent, une compréhension toute relative de ce modèle et une idéologie eugéniste éhontée des tenants anti-vaccinistes, les poussent à prétendre que ne rien faire serait la meilleure solution, que ce modèle prévoit de toute façon un retour à l’équilibre après la phase épidémique virulente, en témoigne la Peste Noire qui a disparu sans le recours à la vaccination au 14ème siècle. Oui mais voilà, la population européenne a été annihilée par la peste, si bien qu’en quelques mois, il ne restait effectivement plus personne à tuer, les hôtes faibles ayant été drastiquement éliminés avec les souches virulentes. Dans un tel cas, on ne peut que s’attendre à une phase épidémique courte. Les survivants pouvaient s’estimer heureux. Le but de la prévention est bien d’éviter au maximum ce lourd tribut humain. Cet argument est donc parfaitement scandaleux en plus d’être bancal.
Dans tous les cas, c’est bien la connaissance fondamentale du monde vivant qui nous permet de nous prémunir efficacement contre le fardeau infectieux, et c’est bien une compréhension intelligente de ces faits qui permet de discuter dans l’arène des citoyens d’actions efficaces de santé publique très éloignées des divagations pseudo-médicales et conspirationnistes.
Bibliographie :
Cohen, 2000, Changing patterns of infectious diseases, Nature.
Carrat et Flahault, 2007, Influenza vaccine : the challenge of antigenic drift, Vaccine.
Webster et al., 1992, Evolution and ecology of influenza A viruses, Microbiological Reviews.
Kuiken et al., 2006 : Host species barriers to Influenza virus infections, Science.
Enserink, 2007, From Two Mutations, an Important Clue About the Spanish Flu, Science.
Ferguson et al., 2003, Ecological and immunological determinants of influenza evolution, Nature.
Park et al., Quantifying the impact of immune escape on transmission dynamics of influenza, Science.
Smith et al., 2004, Mapping the antigenic and genetic evolution of influenza virus, Science.
Luksza et Lässig, 2014, A predictive fitness model for influenza, Nature.

[…] changent tous les ans qu’il faut se faire vacciner tous les ans. Pour comprendre ce mécanisme, un peu de science de l’évolution s’impose. En effet, par divers mécanismes, les souches de virus en circulation dans les populations […]
J’aimeJ’aime
Bonjour,
Super article qui permet de mieux comprendre les enjeux de la lutte contre le virus de la grippe et de la vaccination. Sans vouloir me faire l’avocat du diable, vous citez notamment l’importante capacité de mutation du virus comme facteur d’adaptabilité mais je me demande si l’on ne peut pas prendre en compte la vaccination comme une pression de sélection forte permettant une rapidité d’évolution, d’adaptation du virus ?
Si en effet, chaque année les souches pour lesquelles il existe un vaccin sont moins transmises, en revanche, chaque nouvelle mutation sera particulièrement sélectionnée et augmentera en fréquence dans les populations … Par ce biais, le virus s’adapte plus vite.
Qu’en pensez-vous? Connaissez-vous des travaux relatant ce genre de phénomène ?
RDV
J’aimeJ’aime